Resolução – RDC nº 260, de 23 de setembro de 2002
D.O.U de 03/10/2002
A Diretoria Colegiada da Agência Nacional de Vigilância Sanitária, no uso da atribuição que lhe confere o art. 11,
inciso IV, do Regulamento da ANVISA aprovado pelo Decreto nº 3.029, de 16 de abril de 1999, em reunião
realizada em 11 de setembro de 2002,
considerando a publicação da Resolução-RDC n.º 185, de 22 de outubro 2001, que estabelece requisitos para
dispensa de registro de produtos para saúde;
considerando a necessidade de atualizar a relação de produtos dispensados de registro em substituição à Portaria
n.º 543, de 29 de outubro de 1997, da extinta Secretaria de Vigilância Sanitária do Ministério da Saúde,
adota a seguinte Resolução de Diretoria Colegiada e eu, Diretor-Presidente, determino a sua publicação.
Art. 1º Os produtos para saúde sujeitos ao cadastramento previsto no art. 3º da Resolução-RDC n.º 185/01, são os
constantes da relação do Anexo I desta Resolução.
§ 1º Exclui-se do disposto neste artigo os reagentes para diagnóstico de uso in-vitro.
§ 2º Os produtos referidos neste artigo e seus fornecedores ficam sujeitos ao controle previsto na legislação
sanitária aplicável.
Art. 2º Os produtos para saúde sujeitos a cadastramento, constantes do Anexo I desta Resolução, obedecem às
seguintes exigências e condições:
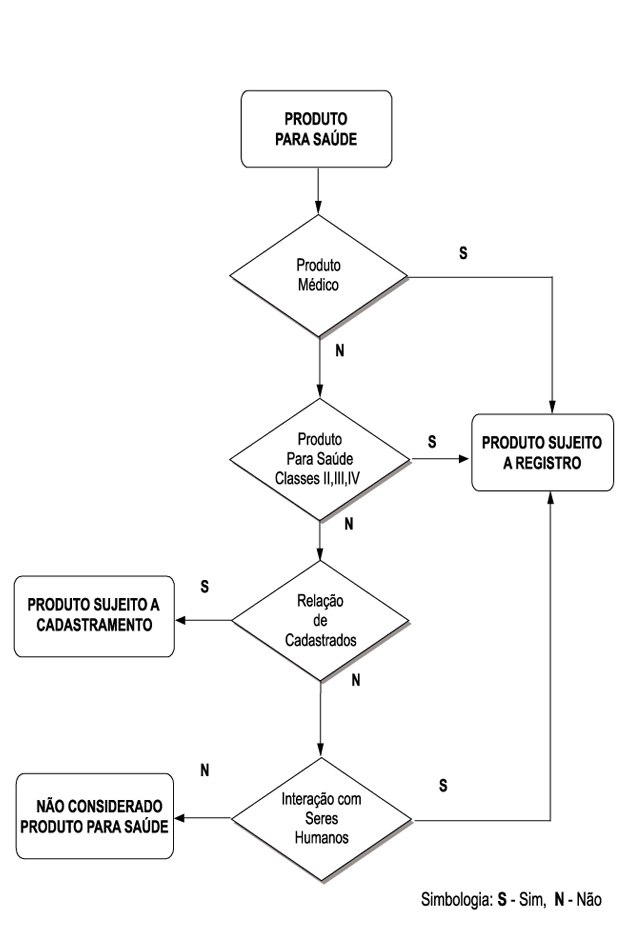
I. Todo produto médico enquadrado em qualquer classe de risco, incluindo suas partes e acessórios, deve ser
registrado na ANVISA.
II. Todo produto para saúde enquadrado em classe de risco II ou superior, conforme classificação de risco da
Resolução-RDC n.º 185/01, incluindo suas partes e acessórios, deve ser registrado na ANVISA.
III. Todo produto de interação com seres humanos, incluindo suas partes e acessórios, não contido no Anexo I
desta Resolução, deve ser registrado na ANVISA.
IV. Todos os demais produtos não enquadrados nas exigências e condições acima descritas e não contidos na
relação do Anexo I desta Resolução, não são considerados produtos para saúde, dispensando manifestação da
ANVISA para sua fabricação, importação, exportação, comercialização, exposição à venda ou entrega ao
consumo.
§ 1º Os produtos de uso ou aplicação em outras áreas que não da saúde, cujas informações apresentadas pelo
fornecedor indiquem uso médico, odontológico ou laboratorial de saúde, destinado a prevenção, diagnóstico,
tratamento ou reabilitação, são considerados produtos médicos e estão sujeitos a registro.
§ 2º As relações exemplificativas de produtos para saúde enquadrados na classe de risco I sujeitos a registro e os
produtos não considerados produtos para saúde, estão disponibilizadas na INTERNET e no site da Agência
Nacional de Vigilância Sanitária – www.anvisa.gov.br.
§ 3º Para fins de entendimento sobre a aplicação das exigências e condições descritas neste artigo, ficam
adotadas as definições e o fluxo indicado no Anexo II desta Resolução.
Art. 4º Ficam sem efeito as manifestações sobre o enquadramento quanto ao registro dos produtos para saúde,
formalizadas pela ANVISA anteriormente à data de publicação desta Resolução.
§ 1º As manifestações referidas neste artigo não incluem os certificados de registro e de isenção de registro
emitidos pela ANVISA, os quais permanecem válidos até a data de seu vencimento.
§ 2º Os fornecedores de produtos, que anteriormente à data de publicação desta Resolução, não eram
considerados produtos para saúde e passaram a enquadrar-se nesta condição, devem protocolar na ANVISA, até
180 (cento e oitenta) dias a partir da referida data, petição de registro ou cadastramento desses produtos, na forma da Resolução-RDC n.º 185/01, ficando autorizada sua fabricação, importação, exportação, comercialização,
exposição à venda ou entrega ao consumo, até manifestação da Agência sobre a petição.
§ 3º O fornecedor cujo produto estava registrado ou declarado isento de registro e teve seu enquadramento
alterado por esta Resolução, deverá protocolar na ANVISA, na forma da Resolução-RDC n.º 185/01:
a) petição de cadastramento, no prazo previsto pela legislação sanitária para a revalidação do registro concedido
pela ANVISA; ou
b) petição de registro, até 6 (seis) meses antes da data de vencimento do certificado de isenção do registro
concedido pela ANVISA.
Art. 5º Para inclusão de produto para saúde em família de produtos, prevista na Resolução-RDC n.º 97/00, que não
tiveram seu enquadramento alterado por esta Resolução, o fornecedor deve adequar as informações do processo
original às disposições da Resolução-RDC n.º 185/01.
Parágrafo único. É vedada a inclusão de produto para saúde em família de produtos registrados ou declarados
isentos de registro pela ANVISA, que tiveram seu enquadramento alterado por esta Resolução.
Art. 6º O produto para saúde sujeito a cadastramento, somente poderá ser fabricado, importado, comercializado,
exposto à venda ou entregue ao consumo, após manifestação da ANVISA declarando o cadastramento do produto,
excetuada a situação descrita no § 2º do artigo 4º desta Resolução.
Art. 7º Esta Resolução será atualizada sempre que informações técnicas e científicas sobre os riscos à saúde,
decorrentes da tecnologia e uso de produtos, indicarem a necessidade de rever os enquadramentos quanto ao
registro dos produtos.
Art. 8º Fica revogada a Portaria n.º 73, de 29 de agosto de 1995, da Secretaria de Vigilância Sanitária do Ministério
da Saúde.
Art. 9º Esta Resolução de Diretoria Colegiada entrará em vigor na data de sua publicação.
GONZALO VECINA NETO
ANEXO I
RELAÇÃO DE PRODUTOS PARA SAÚDE SUJEITOS A CADASTRAMENTO
| A | Produtos não-estéreis indicados para apoio a procedimento desaúde |
| 01 | Adesivo para fixação de produtos ao corpo em procedimento desaúde |
| 02 | Aparelho não invasivo para facilitar a visualização em procedimentomédico |
| 03 | Aparelho para facilitar a visualização em procedimento odontológico |
| 04 | Aparelho para ordenha materna |
| 05 | Desodorante para ostomia |
| 06 | Dispositivo graduado para dosagem manual de medicamentos |
| 07 | Dispositivo para oclusão de orifício natural do corpo emprocedimento de saúde |
| 08 | Equipamento mecânico para deslocamento de pessoasincapacitadas |
| 09 | Equipamento para digitalização, arquivo ou registro de sinais ouimagens médicas |
| 10 | Espátula descartável |
| 11 | Estimulador mecânico de sinais fisiológicos para diagnóstico |
| 12 | Fotopolimerizador odontológico |
| 13 | Garrote para flebotomia |
| 14 | Identificador de pacientes |
| 15 | Marcador dermográfico |
| 16 | Medidor de parâmetros antropométricos para confecção de produtospara saúde |
| 17 | Mesa, cadeira, cama ou outro suporte mecânico de apoio nãoessencial a procedimento médico não cirúrgico |
| 18 | Painel ou suporte com conexões elétricas, hidráulicas ou de gasespara produtos médicos |
| 19 | Processadora de filmes contendo imagens médicas |
| 20 | Projetor ou painel de ortótipos para avaliação visual |
| 21 | Recipiente para acondicionamento de produtos médicosesterilizados |
| 22 | Roupa de cama hospitalar descartável, exceto para cirurgia |
| 23 | Serra, cisalha ou separador de gesso ortopédico |
| B | Produtos não-estéreis indicados para apoio a procedimentolaboratorial de saúde |
| 01 | Centrífuga para laboratório de saúde |
| 02 | Extrator manual de plasma por prensagem |
| 03 | Homogeinizador de sangue e seus derivados |
| 04 | Incubadora para laboratório de saúde |
| C | Produtos para educação física, embelezamento ou estética |
| 01 | Aparelho a bateria para tratamento da pele |
| 02 | Aparelho para procedimento por sucção externa |
| 03 | Brinco e dispositivo furador para sua aplicação |
| 04 | Esterilizador exclusivo de produtos para embelezamento ou estética |
| 05 | Gerador de ozônio para tratamento da pele |
| 06 | Medidor de parâmetros fisiológicos, não destinado a diagnóstico emsaúde |
| 07 | Produto para avaliação física por meio mecânico |
| D | Partes ou acessórios não estéreis de produtos para saúdesujeitos a cadastramento |
ANEXO II
FLUXO PARA ENQUADRAMENTO DE PRODUTOS PARA SAÚDE QUANTO AO REGISTRO
DEFINIÇÕES APLICÁVEIS AO FLUXO PARA ENQUADRAMENTO
As definições a seguir são aplicáveis exclusivamente para fins desta Resolução.
Acessório de produto para saúde: Produto fabricado exclusivamente com o propósito de integrar um produto
para saúde, outorgando ao produto uma função ou característica técnica complementar.
Fornecedor: Fabricante ou importador, conforme definido na Resolução-RDC nº 185/01.
Parte de produto para saúde: Componente fabricado exclusivamente com o propósito de integrar um produto
para saúde, sem o qual o produto é funcionalmente deficiente ou inoperante.
Produto de interação com seres humanos: Produto para saúde, suas partes ou acessórios, cujo uso estabelece
interação física ou fisiológica com pessoa submetida a procedimento médico ou odontológico, assim como produto
ativo ou invasivo de educação física, embelezamento ou estética que estabelece esta interação, conforme indicado
pelo fornecedor.
Produto destinado a prevenção: Produto médico, suas partes e acessórios, cujo uso promove a segurança
sanitária do consumidor, paciente, operador ou terceiros envolvidos em procedimento médico, odontológico ou
laboratorial de saúde, conforme indicado pelo fornecedor.
Produto destinado a tratamento ou reabilitação: Produto médico, suas partes e acessórios, cujo uso favorece a
cura ou alívio de doença ou disfunção orgânica de pessoa submetida a procedimento médico ou odontológico,
conforme indicado pelo fornecedor.
Produto destinado para diagnóstico: Produto médico, suas partes e acessórios, que transforma informações
obtidas do organismo de pessoa submetida a procedimento médico, odontológico ou laboratorial de saúde, em
dados utilizados para avaliar condição fisiológica ou funcional deste organismo, conforme indicado pelo fornecedor.
Produto médico: Produto para a saúde, tal como equipamento, aparelho, material, artigo ou sistema de uso ou
aplicação médica, odontológica ou laboratorial, destinado à prevenção, diagnóstico, tratamento, reabilitação ou
anticoncepção e que não utiliza meio farmacológico, imunológico ou metabólico para realizar sua principal função
em seres humanos, podendo entretanto ser auxiliado em suas funções por tais meios.





